1
Informe
El impacto de la competencia de los biosimilares en Europa
1. COVID-19: La pandemia no ha supuesto una disminución en el número de biosimilares autorizados por la EMA pero sí han disminuido en general las prescripciones de medicamentos biológicos.
2. AHORROS: Se estima que la competencia biosimilar ha generado, sólo en 2020, 5.700 millones de euros de ahorro en Europa. Sin embargo, las bajadas de precio no siempre se relacionan con un mayor acceso.
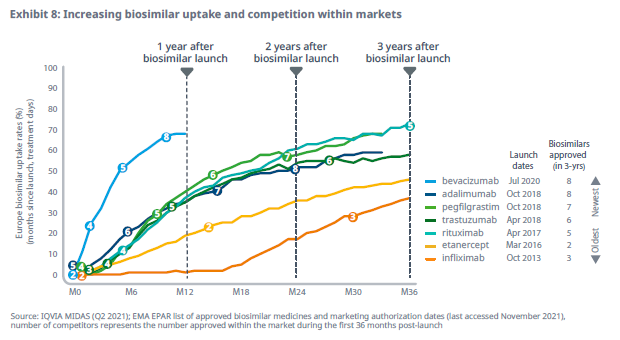
3. ACCESO: El acceso no aumenta por igual en todas las moléculas. Sí se observa crecimiento en pegfilgrastim o adalimumab, pero no en infliximab, rituximab o trastuzumab.
4. COMPETENCIA: La competencia en nuevas moléculas biosimilares autorizadas es cada vez más intensa. Además, nuevos actores entran al mercado (China, India y Brasil principalmente).
5. FUTURO: En los próximos años expira la patente de muchos biológicos (139 moléculas), Oncología e Inmmunología especialmente. La mitad de ese mercado, aún bajo patente, se concentra en tan solo 13 moléculas
IQVIA, Diciembre 2021.
https://www.iqvia.com/library/white-papers/the-impact-of-biosimilar-competition-in-europe
2
Artículo científico
Cambio de productos biológicos originales a biosimilares: la visión de un sistema sanitario integrado
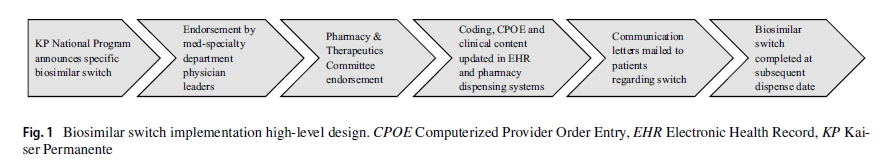
Este trabajo proporciona un “procedimiento” para ayudar a los sistemas de salud a implementar un programa de switch de original a biosimilar a partir de su propia experiencia. Consideran que los aprendizajes obtenidos a lo largo del curso de estos cambios desde el primero en 2016, han optimizado su estrategia para futuros biosimilares.
Desde 2016, Kaiser Permanente Colorado ha llevado a cabo varios cambios de biosimilares, comenzando con el primer biosimilar introducido en el mercado, el filgrastim. En este tiempo ha podido cambiar con éxito el 91,8% de los pacientes que recibían infliximab, el 99,8% que recibían rituximab y el 100% de aquellos que recibían filgrastim, trastuzumab o bevacizumab a sus respectivos biosimilares. El proceso propuesto parte de un enfoque colaborativo donde son esenciales el servicio de farmacia, los servicios clínicos, soporte de gestión de datos y los pacientes. El artículo incluye una tabla donde detalla cada contribución estratégica, quién la realiza y su papel y expectativas ante el programa de switch. Aportan también la carta que desde KP se envió a los pacientes para informarles de su switch. Constituye, por tanto, una excelente “Hoja de Ruta” a seguir para aquellas entidades que quieran realizar con éxito esta conversión de biológico de referencia a biosimilar.
Bhardwaja B, et al. Noviembre 2021, BioDrugs.
https://pubmed.ncbi.nlm.nih.gov/34817847
3
Informe
Compra pública de medicamentos biosimilares en el Sistema Nacional de Salud
Informe elaborado por la consultora especializada en contratación pública sanitaria, Tesera de Hospitalidad, y encargado por BioSim, cuya presentación pública tuvo lugar el pasado 30 de noviembre. El objetivo es servir de libro blanco de la compra pública de biosimilares a la Administración, es decir, guiar a los órganos de contratación para configurar sus procedimientos de licitación.
Por una parte, recoge aspectos generales de la contratación pública y, por otra, analiza expedientes publicados y resoluciones de los tribunales de contratación. Todo ello con el objetivo de establecer recomendaciones prácticas para adecuar la Ley 9/2017 de Contratos del Sector Público a la adquisición de medicamentos biosimilares. Finaliza con la propuesta de un modelo de compra optimizado que concilia el seguimiento de la Ley con las particularidades de los medicamentos biológicos. Incluye un checklist para el órgano de contratación.
BioSim, noviembre 2021.
4
Póster
Aprovechando el potencial de los programas de beneficios compartidos para los productos biológicos. Un análisis comparativo europeo de los retos en su aplicación
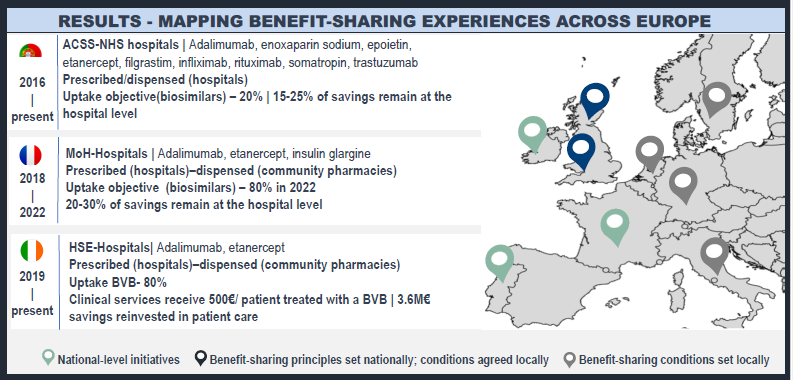
Barcina-Lacosta T, et al. ISPOR.
5
Artículo científico
Estudio del switch de adalimumab por su biosimilar en un hospital de tercer nivel
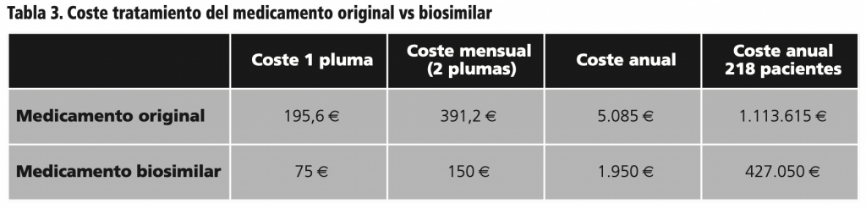
Un equipo de profesionales sanitarios del servicio de farmacia del Hospital San Pedro de Logroño, un hospital de tercer nivel, han desarrollado un estudio descriptivo, observacional, longitudinal y retrospectivo del ahorro económico anual generado debido al cambio de adalimumab original a biosimilar y la proporción de pacientes que permanecen en dicho tratamiento.
Sus resultados indican que, en una muestra de 2018 pacientes, únicamente 9, alrededor del 4%, de todos los que cambiaron al biosimilar previamente tuvieron que volver al medicamento original.
Teniendo en cuenta la diferencia entre el medicamento original y el biosimilar tanto de precio de adquisición como de coste anual por paciente en dicho hospital, que de por si es significativa y puede observarse en la tabla, el ahorro anual que se estimó por dicho cambio fue de 683.560€. Esto supone que, sin que redunde en una disminución de la efectividad del tratamiento, es posible contribuir a la eficiencia y sostenibilidad del sistema sanitario a través de este tipo de procedimientos.