1
Formulaciones intravenosa y subcutánea de trastuzumab, y biosimilares de trastuzumab: implicaciones para la práctica clínica
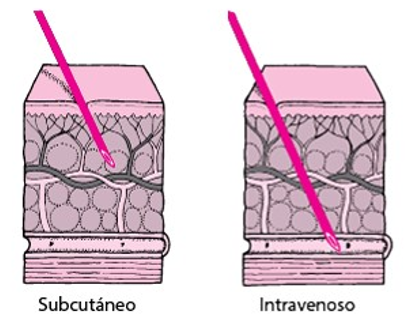
Esta revisión pretende ahondar en las dos opciones actuales de administración de trastuzumab (terapia biológica indicada para el tratamiento del cáncer de mama (HER2)- positivo y el cáncer gástrico metastásico). Los biosimilares de trastuzumab se administran por vía intravenosa (IV), mientras que el trastuzumab de referencia presenta vía IV y subcutánea (SC), esta última aún protegida por patente.
Ambas formulaciones demuestran perfiles farmacológicos y clínicos comparables en eficacia y seguridad. Por lo tanto, a la hora de decidir entre las distintas vías de administración deben tenerse en cuenta otros factores como el coste, la preferencia de los pacientes y el valor añadido que cada formulación supone para ellos y para el sistema sanitario. Los estudios que comparan el trastuzumab IV con el SC indican que cada formulación ofrece ventajas únicas a los pacientes en función de su situación clínica y preferencias individuales. Paralelamente al desarrollo del trastuzumab SC, los biosimilares de trastuzumab IV constituyen otra opción de tratamiento que, en vista de su reducido coste podrían mejorar el acceso de los pacientes y aumentar sostenibilidad para gestores sanitarios.
Intravenous and subcutaneous formulations of trastuzumab, and trastuzumab biosimilars: implications for clinical practice. Waller, C.F., Möbius, J. & Fuentes-Alburo, A. 2021. Br J Cancer
https://www.nature.com/articles/s41416-020-01255-z.pdf
2
Barreras a los incentivos a la prescripción de biosimilares en el contexto de la gestión clínica en España
Este artículo analiza las barreras al establecimiento de incentivos a la prescripción de biosimilares en España en el contexto particular de la gestión clínica, entendida como la gestión de los servicios sanitarios a nivel micro, orientada a conseguir mejores resultados de salud para los pacientes y donde los profesionales sanitarios tienen un papel clave en la toma de decisiones. Los incentivos son además un elemento importante de la gestión clínica.
En España, no hay tanta tradición de uso de incentivos monetarios y no monetarios como en otros países europeos, donde existen ya varios ejemplos de iniciativas que buscan la promoción de biosimilares a través de diferentes tipos de incentivos. Las barreras se presentan desde dos perspectivas. En primer lugar, en función de la naturaleza de la barrera y en segundo lugar según los agentes implicados. Por último y quizás de especial relevancia, los autores proponen varias recomendaciones para superar estos obstáculos a nivel nacional.
Barriers to Biosimilar Prescribing Incentives in the Context of Clinical Governance in Spain Lobo, F and Río-Alvarez, I. Pharmaceuticals 2021, 14(3), 283
https://www.mdpi.com/1424-8247/14/3/283/htm
3
Intercambiabilidad de los biosimilares: ¿Qué nivel de evidencia clínica se necesita para apoyar la designación de intercambiabilidad en los Estados Unidos?
Este trabajo analiza pormenorizadamente la posibilidad de designar como sustituibles por parte de la FDA (interchangeable) a determinados biosimilares cuyo titular de la comercialización lo solicite. Entre muchas otras, esta condición de intercambiabilidad supone una de las barreras regulatorias que dificulta le entrada masiva de biosimilares en el mercado estadounidense. El artículo sugiere que, una vez demostrada biosimilitud en base a la totalidad de la evidencia, el riesgo de que dos biológicos se intercambien es insignificante, ya que el exigente ejercicio de comparabilidad analítica, acompañado de estudio de bioequivalencia farmacocinética y de estudios confirmatorios en pacientes, son la mejor garantía de que ambos productos puedan ser intercambiados. Sin embargo, teniendo en cuenta el planteamiento de la FDA, se reconoce el reto científico y económico que supone realizar estudios clínicos adecuados para concluir acerca de la designación de sustituible y se ofrecen diversas alternativas.
Interchangeability of Biosimilars: What Level of Clinical Evidence is Needed to Support the Interchangeability Designation in the United States?. Alvarez, D. F. et al. 2020. BioDrugs: clinical immunotherapeutics, biopharmaceuticals and gene therapy, 34(6), 723–732
https://doi.org/10.1007/s40259-020-00446-7
4
Financiación de la innovación gracias a la adopción de biosimilares anti-TNF-α: El impacto económico en Italia
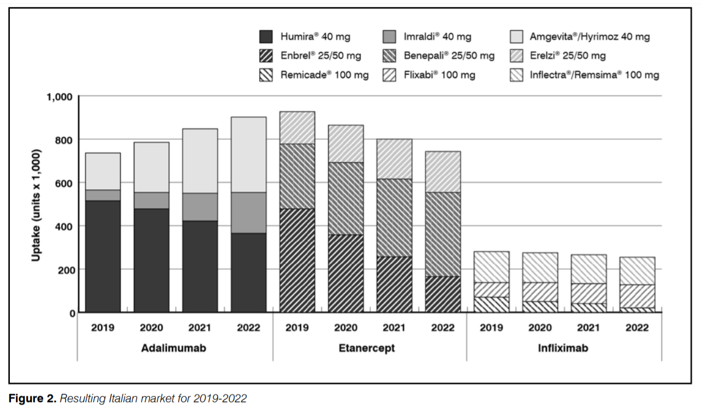
Este trabajo, firmado por la consultora experta en estudios del mercado sanitario AdRes, trata sobre el impacto de la adopción de biosimilares de anti-TNF y analiza el beneficio en la redistribución de los recursos que esta permite.
Italia ha sido un país muy proactivo en adoptar medidas y políticas de incentivación que ha dado frutos desiguales según la región, pues se observa gran heterogeneidad los grados de adopción. El artículo sostiene que se espera un crecimiento del mercado de biosimilares desde el 50% de hoy (2019-2020) hasta el 67% (2021-2022). El crecimiento en la adopción de biosimilares de anti-TNF se espera que incremente el ahorro de 96,2 € millones en 2019 a 161,5 € millones en 2022. Además, se ofrece una conversión de estas cifras a tratamientos, en concreto: el ahorro promovido por los biosimilares permitiría a 2.600-4.800 nuevos pacientes afectados por enfermedades raras, ser tratados sin necesidad de incrementar el gasto farmacéutico.
Funding Innovation Thanks to Anti-TNF-α Biosimilars Uptake: The Economic Impact in Italy. Povero, M & Pradelli, L. 2020. Farmeconomia. Health economics and therapeutic pathways
5
Implantación y ejecución exitosas de un programa de cambio a biosimilar: la experiencia de Berkshire West
Traemos a esta sección este artículo de 2019, por su encaje en la temática abordada en el Webinar “ganancias compartidas y biosimilares” organizado por BioSim el pasado 24 de marzo.
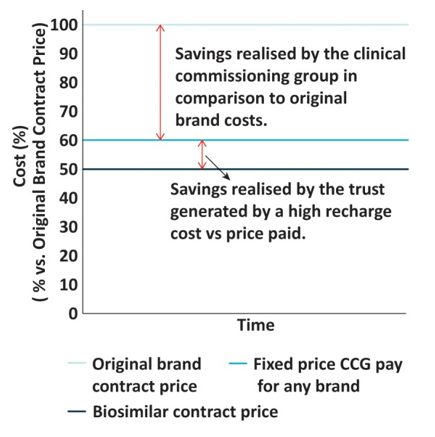
El trabajo hace públicos los resultados de un programa de cambio (switch) gestionado por profesionales sanitarios y financiado a través de un novedoso modelo de incentivación de precio fijo. Es reseñable que no sólo se publican los resultados clínicos o económicos del programa sino también la experiencia de los pacientes que habían participado en este programa de cambio entre etanercept original y biosimilar.
Se observaron similares efectos clínicos, a la vez que mantiene resultados similares informados por los pacientes y una buena experiencia de los mismos. La entidad sanitaria local recibió como parte del acuerdo 95.000 libras del ahorro debido al programa de cambio.