1
Informe
El fomento de los medicamentos biosimilares, entre las recomendaciones de la CNMC en su estudio sobre el Mercado de Distribución Mayorista de Medicamentos en España

En él detecta una falta de competencia en los mercados de medicamentos en competencia (originales de marca/genéricos y biológicos/biosimilares) a pesar de que “la competencia es posible, porque dejan de estar protegidos por patentes y pueden aparecer medicamentos genéricos y biosimilares”. No obstante, consideran que “la regulación no incentiva suficientemente la competencia”. De un análisis comparado de las experiencias de otros países extraen algunas pautas para mejorar esta competencia reduciendo su precio en beneficie de consumidores y del Sistema Nacional de Salud. Entre las propuestas para el fomento de los biosimilares proponen: 1) reforzar el análisis y la atención a la evidencia sobre la intercambiabilidad de los biosimilares con medicamentos biológicos con objeto de valorar posicionamientos sobre esta cuestión y 2) Desarrollar más campañas de información y educación sanitaria sobre los medicamentos genéricos y biosimilares.
Comisión Nacional de los Mercados y de la Competencia
https://www.cnmc.es/sites/default/files/4171318.pdf
2
Informe
Nuevos candidatos a biosimilar en evaluación por el CHMP

European Medicines Agency
https://www.ema.europa.eu/en/medicines/medicines-human-use-under-evaluation
3
Informe
Medicamentos Biosimilares
La Organización de Consumidores y Usuarios (OCU), asociación privada independiente y sin ánimo de lucro que busca la información y atención de los consumidores y la defensa de sus intereses, publica este completo informe sobre los medicamentos biosimilares. A través de un lenguaje sencillo explica qué son estos fármacos, las diferencias con los medicamentos genéricos, el impacto económico que suponen al Sistema Nacional de Salud dada la diferencia de precio con el medicamento original, cuestión que analiza en detalle, y la variabilidad de uso entre regiones. Finaliza el informe con la declaración de la voluntad de la OCU de unirse a las recomendaciones de la AIReF y la CNMC para fomentar su utilización, ya que los medicamentos biosimilares “son una alternativa eficaz y segura a los biológicos originales, permiten liberar recursos económicos para otras necesidades sanitarias y ayudan a garantizar el acceso de los pacientes a este tipo de medicamentos biológicos que por regla general son extremadamente caros”.
Organización de Consumidores y Usuarios
https://www.ocu.org/salud/medicamentos/informe/medicamentos-biosimilares
4
Artículo científico
El efecto de los objetivos de prescripción de biosimilares de eritropoyetinas en el comportamiento de prescripción de los médicos en Alemania
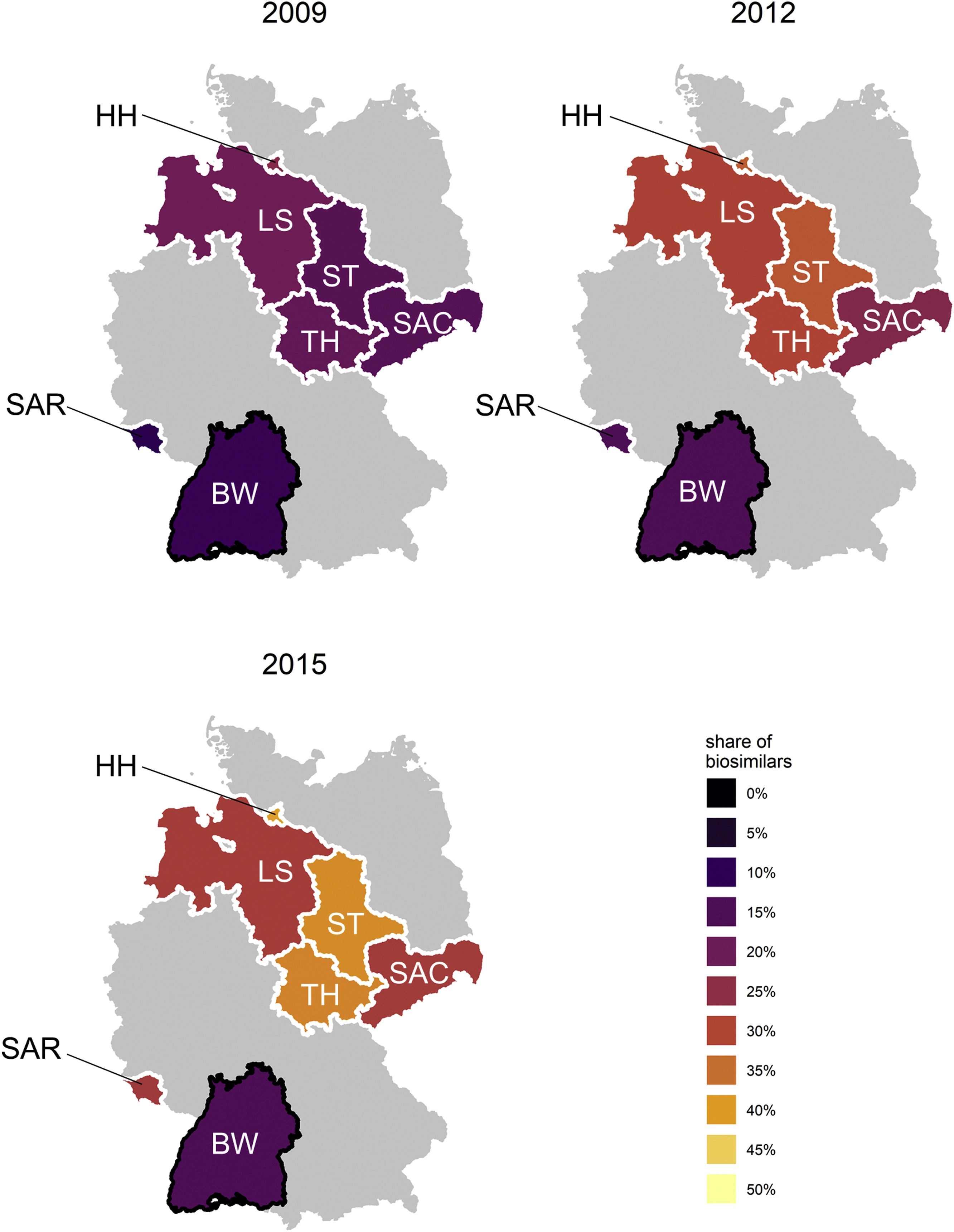
Birkner, B. and Blankart, K. Health Policy Analysis, Mayo, 2022
https://www.sciencedirect.com/science/article/abs/pii/S1098301522001474?dgcid=rss_sd_all
5
Editorial
Nuevas perspectivas de los mercados europeos de productos biológicos, incluidos los biosimilares
Editorial firmada por investigadores de la Universidad de Lovaina y el grupo MABEL donde recogen las conclusiones del especial 'Biosimilares en Europa' (MDPI) en el que BioSim publicó dos artículos, y que se lanzó justamente con motivo del quinto aniversario de la iniciativa MABEL. Según ellos, se trata de crear un entorno político que no sólo promueva la competencia, sino que también proteja la viabilidad económica y evite la escasez, pero ¿cómo? Entre sus reflexiones destacan la necesidad de:
1) “Cosechar” las recompensas de la competencia biosimilar. Citan el análisis de impacto presupuestario en España. Los ahorros entre 2009- 2019 fueron enormes en términos absolutos, pero en términos relativos ascendieron a menos del 4% del gasto farmacéutico en 2019.
2) Recetar productos biológicos de mejor valor. Identifican un papel importante para los procedimientos de licitación hospitalaria para lograr la selección de productos biológicos de mejor valor.
3) Optimizar y armonizar los procedimientos regulatorios pues se observa falta de uniformidad que puede aumentar el coste del desarrollo de biosimilares y también puede dificultar el acceso de los pacientes.
4) Educar a los pacientes, donde instan a la Comisión Europea a desarrollar un sitio web dedicado para pacientes (y profesionales de la salud) sobre biosimilares.
5) Ir más allá de la búsqueda de los obstáculos para la entrada y la competencia en el mercado de biosimilares y analizar el impacto de las estrategias para superar estos obstáculos.
Simoens, S. and Huys, I. Pharmaceuticals, mayo 2022
https://www.mdpi.com/1424-8247/15/5/615/pdf?version=1652759534
