1
Informe
Evaluación del impacto de las regulaciones de promoción y publicidad en la adopción de biosimilares
 Este informe evalúa cómo la regulación de la promoción farmacéutica afecta a la utilización de biosimilares en siete países de la OCDE (Australia, Bélgica, Dinamarca, Francia, Alemania, Italia y Corea del Sur) y en tres áreas terapéuticas (oncología, reumatología y diabetes). Aunque la promoción convencional está estrictamente regulada, las tácticas menos directas (formación clínica, apoyo a pacientes, patrocinio a investigadores) reciben poca supervisión, y la efectividad de leyes de transparencia es difícil de evaluar. Según el informe, la adopción de biosimilares varía según la molécula y el entorno: oncológicos hospitalarios como bevacizumab y rituximab alcanzan casi el 100 % del mercado en Dinamarca, Francia y Alemania, mientras que trastuzumab o insulina glargina tienen menor penetración. No se observa una relación consistente entre la estricta regulación y la utilización, mientras que otras políticas como compras centralizadas, precios y regulación de prescripción tienen una mayor influencia. Además, señala que las compañías innovadoras mantienen ventajas competitivas mediante incentivos, dispositivos, nuevas formulaciones o herramientas digitales que favorecen sus productos frente a los biosimilares.
Este informe evalúa cómo la regulación de la promoción farmacéutica afecta a la utilización de biosimilares en siete países de la OCDE (Australia, Bélgica, Dinamarca, Francia, Alemania, Italia y Corea del Sur) y en tres áreas terapéuticas (oncología, reumatología y diabetes). Aunque la promoción convencional está estrictamente regulada, las tácticas menos directas (formación clínica, apoyo a pacientes, patrocinio a investigadores) reciben poca supervisión, y la efectividad de leyes de transparencia es difícil de evaluar. Según el informe, la adopción de biosimilares varía según la molécula y el entorno: oncológicos hospitalarios como bevacizumab y rituximab alcanzan casi el 100 % del mercado en Dinamarca, Francia y Alemania, mientras que trastuzumab o insulina glargina tienen menor penetración. No se observa una relación consistente entre la estricta regulación y la utilización, mientras que otras políticas como compras centralizadas, precios y regulación de prescripción tienen una mayor influencia. Además, señala que las compañías innovadoras mantienen ventajas competitivas mediante incentivos, dispositivos, nuevas formulaciones o herramientas digitales que favorecen sus productos frente a los biosimilares.
OECD
2
Vídeo
Biosimilares en patologías oculares: aflibercept y ranibizumab

CGCOF, Medicina Televisión y BioSim
https://www.youtube.com/watch?v=pe8MakCuG-c
3
Artículo de prensa
La I+D y fabricación de medicamentos biosimilares desde dentro

Durante la jornada, las ponentes destacaron la importancia de fomentar un diálogo riguroso y transparente entre la industria biotecnológica y los periodistas, así como el papel clave de la formación continua para combatir la desinformación. Se subrayó también el alto grado de sofisticación tecnológica y los estrictos estándares de calidad que caracterizan a los biosimilares, en un contexto de posible simplificación regulatoria de los ensayos clínicos por parte de agencias como la EMA y la FDA. Asimismo, se puso en valor el liderazgo de España en investigación biomédica y el impulso a las terapias biológicas.
La parte práctica incluyó una visita a la planta de producción de mAbxience, donde los asistentes conocieron de primera mano las distintas fases del proceso de fabricación y control de calidad de un biosimilar. La jornada sirvió además para resaltar el impacto humano y económico de la compañía, con más de 1.100 profesionales y una fuerte implantación en León.
IM Médico
4
Reporte
Aspectos destacados de la reunión del Comité de Medicamentos de Uso Humano de diciembre de 2025
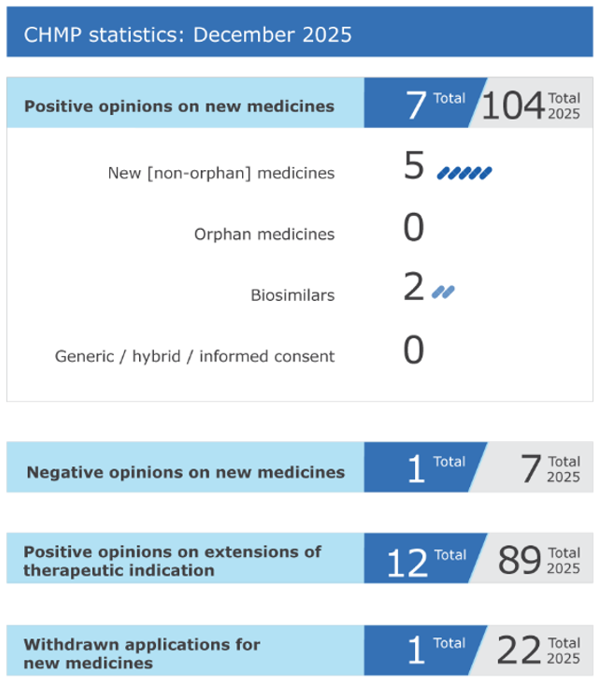
Agencia Europea de Medicamentos
5
Informe
Capacity building to support the uptake of biosimilars in a multistakeholder approach

Dentro del marco de dicho proyecto, se ha publicado recientemente este informe, que analiza las políticas y prácticas nacionales sobre biosimilares en 32 países europeos (Estados miembros de la UE, países de la AELC y el Reino Unido), así como su impacto en términos de ahorro y mejora del acceso de los pacientes. Además, identifica las principales barreras para la adopción de biosimilares, destaca ejemplos de buenas prácticas y ofrece una perspectiva sobre los biosimilares actualmente en desarrollo.
La investigación se llevó a cabo mediante una metodología mixta que incluyó revisiones bibliográficas, análisis de datos cuantitativos, entrevistas y una encuesta en línea a distintos grupos de interés. El estudio identifica que la compra hospitalaria mediante licitación y el cambio de tratamiento son las herramientas que mejor impulsan la competencia, e incluye una serie de recomendaciones orientadas a optimizar el uso de los biosimilares.
