1
Informe
Los pacientes antes los biosimilares: visión y expectativas
La Asociación Española de Medicamentos Biosimilares (BioSim) ha presentado el informe 'Los pacientes ante los biosimilares: visión y expectativas', centrado en la percepción y necesidades formativas e informativas de los pacientes en torno a los biosimilares. Este estudio, basado en un grupo focal con nueve asociaciones de pacientes, destaca la necesidad de una comunicación clara, accesible y comprensible sobre la eficacia, efectos secundarios y beneficios clínicos reales de los tratamientos, dejando de lado el impacto económico a la hora de llevar a cabo un cambio a biosimilar. Por otro lado, este informe pone de manifiesto la relevancia de que todos los profesionales sanitarios, y no solo los médicos, participen de forma activa en esta educación terapéutica. Con este documento, BioSim reafirma su compromiso con los pacientes mediante el desarrollo de recursos informativos y formaciones que promuevan la confianza en los biosimilares.
BioSim
https://www.biosim.es/informes/los-pacientes-ante-los-biosimilares-vision-y-expectativas/
2
Artículo científico
Acelerando el acceso temprano a agentes Anti-TNF alfa a través de los medicamentos biosimilares en el manejo de la Enfermedad Inflamatoria Intestinal
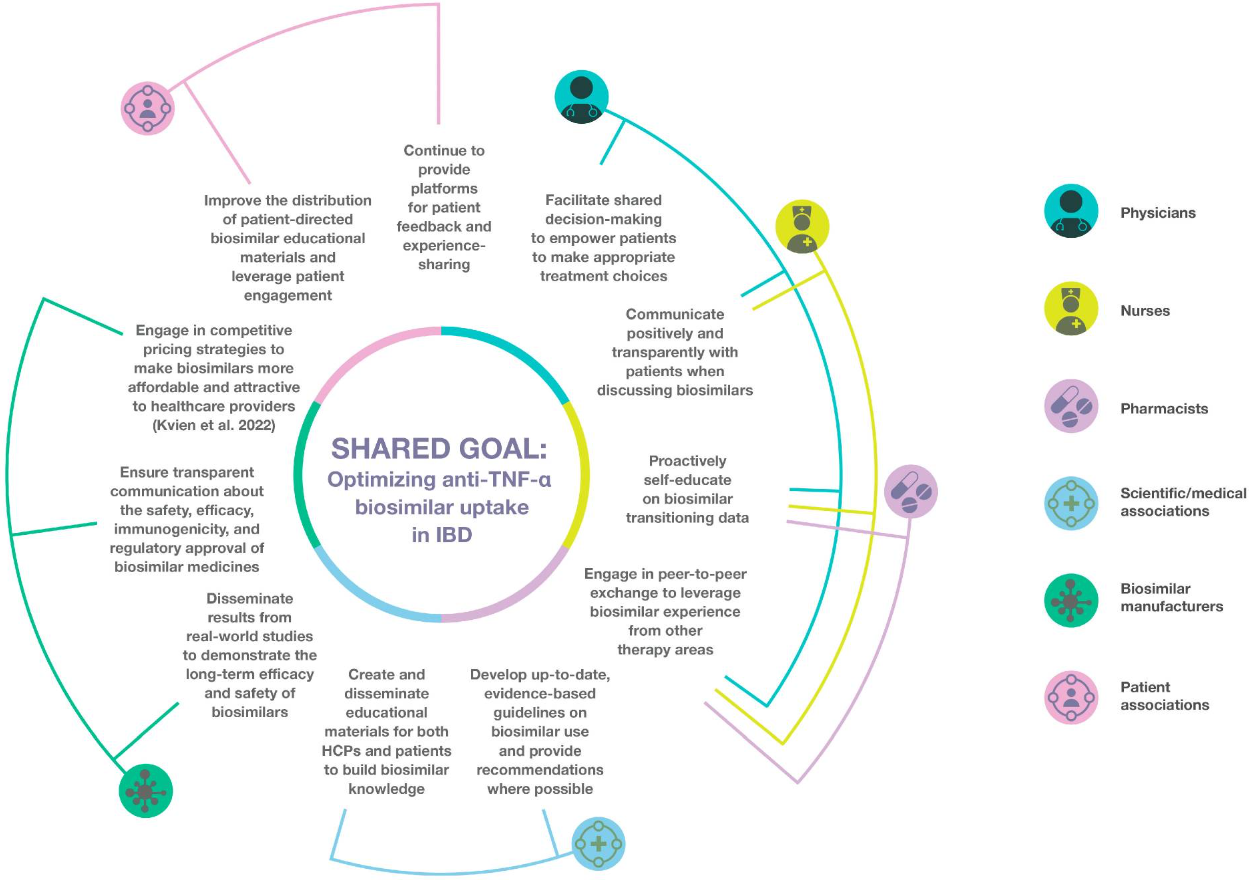 El “Early treatment” (o acceso temprano) se basa en el uso de un medicamento no destinado para primeras líneas de tratamiento en etapas tempranas de una enfermedad, antes de que esta progrese y cause daños irreversibles. Este artículo recoge las reflexiones de un panel de ocho expertos acerca de las necesidades actuales no cubiertas en el manejo temprano y efectivo de la Enfermedad Inflamatoria Intestinal (EII), identificando las posibles barreras para este acceso temprano a anti-TNF-α y proponiendo diferentes estrategias para derribarlas. Por otro lado, frente a la dificultad de aprovechar esta ventana de oportunidad por el elevado coste de las terapias biológicas, se destaca al biosimilar como una herramienta fundamental para acelerar y optimizar el “Early Treatment”, particularmente en pacientes con enfermedad de Crohn de moderada a severa, pudiendo ofrecer beneficios sustanciales tanto para los pacientes con EII como para los sistemas de salud.
El “Early treatment” (o acceso temprano) se basa en el uso de un medicamento no destinado para primeras líneas de tratamiento en etapas tempranas de una enfermedad, antes de que esta progrese y cause daños irreversibles. Este artículo recoge las reflexiones de un panel de ocho expertos acerca de las necesidades actuales no cubiertas en el manejo temprano y efectivo de la Enfermedad Inflamatoria Intestinal (EII), identificando las posibles barreras para este acceso temprano a anti-TNF-α y proponiendo diferentes estrategias para derribarlas. Por otro lado, frente a la dificultad de aprovechar esta ventana de oportunidad por el elevado coste de las terapias biológicas, se destaca al biosimilar como una herramienta fundamental para acelerar y optimizar el “Early Treatment”, particularmente en pacientes con enfermedad de Crohn de moderada a severa, pudiendo ofrecer beneficios sustanciales tanto para los pacientes con EII como para los sistemas de salud.
Journal of Clinical Medicine
https://pmc.ncbi.nlm.nih.gov/articles/PMC11900083/
3
Reporte
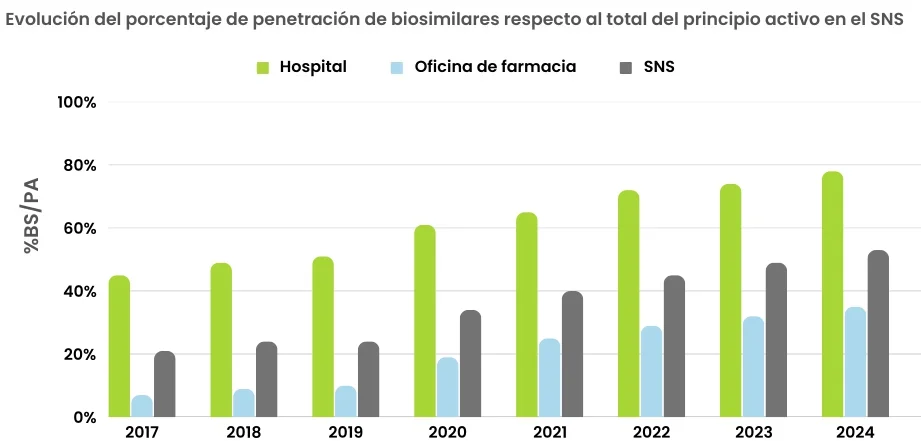
Biosimilares en cifras enero-junio 2024
BioSim
https://www.biosim.es/medicamentos-biosimilares-en-cifras/
4
Artículo científico
Definición de un marco para mercados globales sostenibles de biosimilares utilizando hallazgos de una revisión bibliográfica dirigida
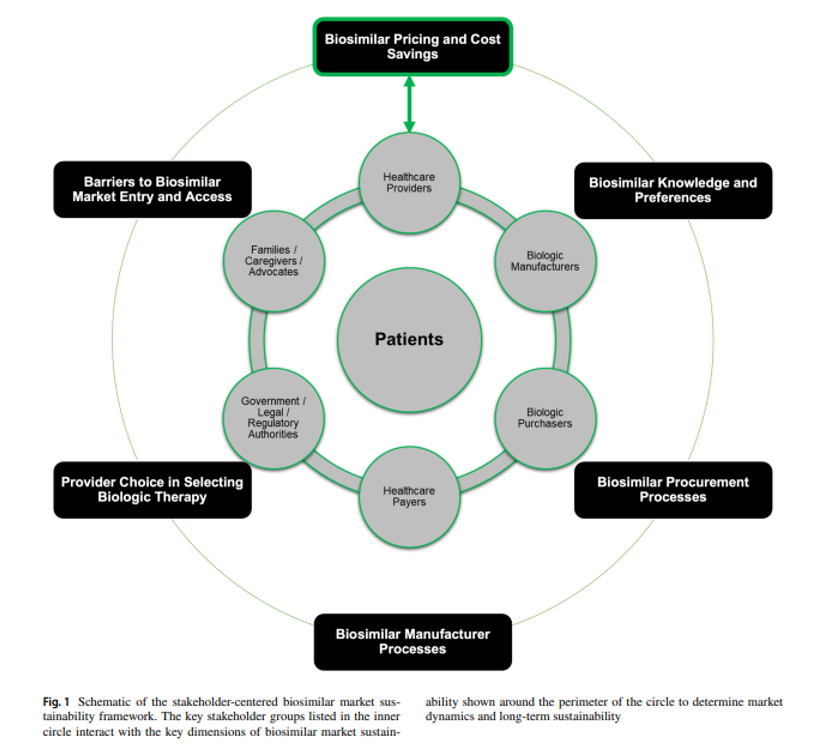
Este estudio propone un marco integral para promover la sostenibilidad de los mercados globales de biosimilares a partir de una revisión dirigida de la literatura, estructurada en seis dimensiones clave: barreras legales y regulatorias que impactan sobre el acceso, procesos de fabricación, elección del proveedor, conocimiento y preferencias, precios y ahorros, y procesos de compra.
Para cada una de estas dimensiones, se identifican diferentes grupos de interés: pacientes, proveedores de salud, fabricantes, compradores, pagadores y autoridades regulatorias. Teniendo todo esto en cuenta, se elabora un marco que trata de sortear los principales desafíos que amenazan de forma directa la sostenibilidad del mercado de los biosimilares, como precios excesivamente bajos o políticas de compra centradas únicamente en el precio, condiciones que pueden llevar al abandono del mercado por parte de fabricantes, afectando el acceso y la innovación. En definitiva, este estudio ofrece una guía para el diseño de políticas colaborativas y estrategias centradas en el paciente para equilibrar la competencia, garantizar la calidad y asegurar la viabilidad del mercado a nivel mundial a largo plazo.
BioDrugs
https://link.springer.com/article/10.1007/s40259-025-00710-8
5
Reporte
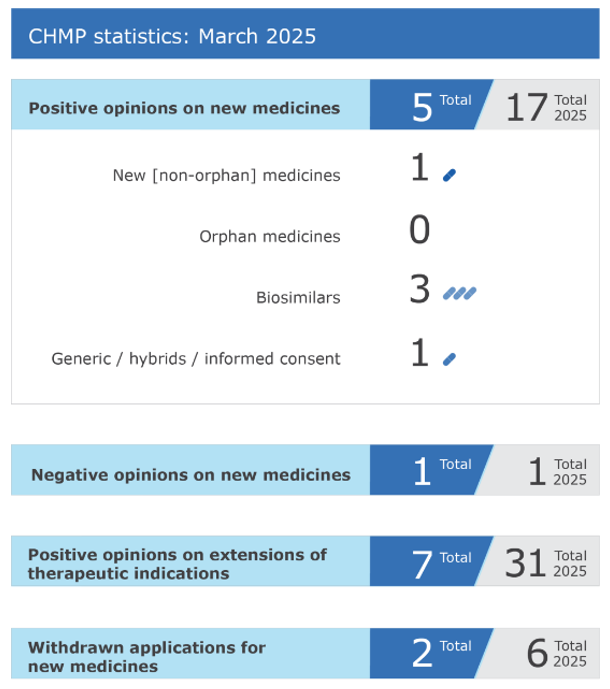
Aspectos destacados de la reunión del Comité de Medicamentos de Uso Humano de marzo de 2025