1
Artículo científico
El tratamiento con inhibidores del factor de necrosis tumoral desde el diagnóstico es más eficaz y menos costoso que la estrategia “escalonada” convencional para pacientes con enfermedad de Crohn activa: un análisis de coste-efectividad del ensayo PROFILE
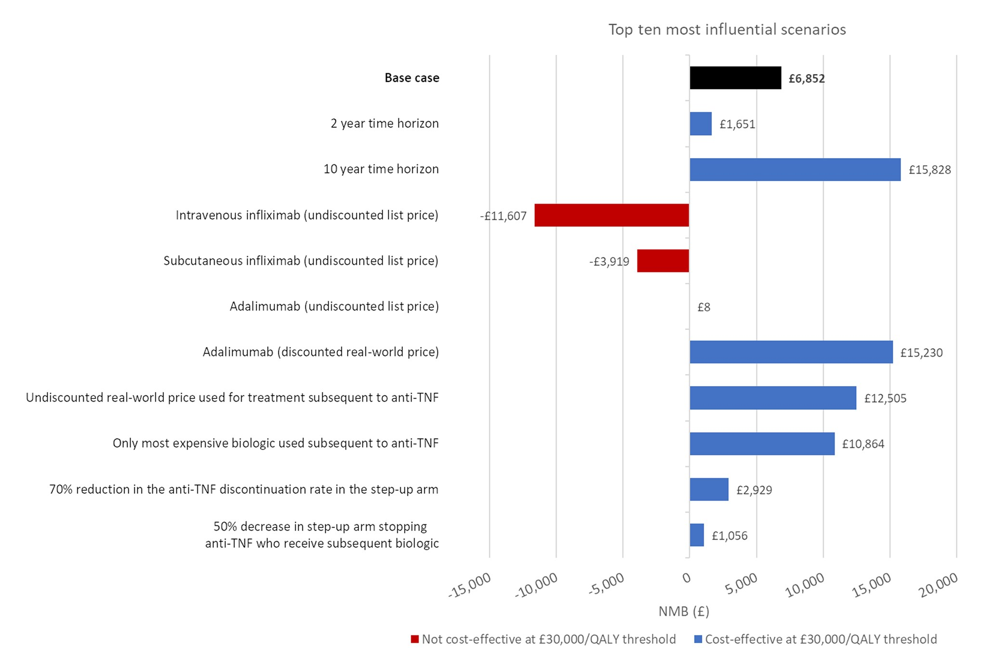 El estudio PROFILE demostró que la terapia 'top-down' en la enfermedad de Crohn, con la combinación de infliximab e inmunomodulador desde el diagnóstico, es más eficaz y segura durante un año en comparación con el tratamiento convencional de 'escalada acelerada'. Este nuevo estudio analiza la relación coste-efectividad de las estrategias de tratamiento.
El estudio PROFILE demostró que la terapia 'top-down' en la enfermedad de Crohn, con la combinación de infliximab e inmunomodulador desde el diagnóstico, es más eficaz y segura durante un año en comparación con el tratamiento convencional de 'escalada acelerada'. Este nuevo estudio analiza la relación coste-efectividad de las estrategias de tratamiento.
El ensayo incluyó a 386 adultos recién diagnosticados con enfermedad de Crohn activa, los cuales fueron asignados aleatoriamente a cada una de las estrategias. Los resultados del análisis base indican que la estrategia 'top-down' superó a la de 'escalada acelerada', ya que el inicio del tratamiento intravenoso con infliximab desde el diagnóstico produjo una ganancia incremental de 0,17 QALYs por paciente en un período de 5 años, siendo además menos costoso, ahorrando £1.681 por paciente en el mismo período. Se obtuvieron beneficios clínicos similares al modelar infliximab subcutáneo y adalimumab, y los mayores ahorros de costes se lograron con adalimumab: £10.059 por paciente durante 5 años. Por ello, se sugiere que esta estrategia sea el estándar de atención para los pacientes recién diagnosticados con enfermedad de Crohn activa.
Journal of Crohn’s and Colitis
https://academic.oup.com/ecco-jcc/article/19/9/jjaf150/8296886
2
Vídeo
Biosimilares en osteoporosis: denosumab y teriparatida

CGCOF, Medicina Televisión y BioSim
https://www.youtube.com/watch?v=eRPKci1jE0Y
3
Informe
Medicamentos humanos en 2025

Agencia Europea de Medicamentos
https://www.ema.europa.eu/en/documents/report/human-medicines-2025_en.pdf
4
Noticia
NICE recomienda opciones de tratamiento para la esclerosis múltiple altamente activa y el cáncer colorrectal metastásico
lSiguiendo con su estrategia de promover los biosimilares dentro de su hoja de ruta 2025-2026, NICE ha aprobado el uso de bevacizumab para el cáncer colorrectal metastásico en Inglaterra y Gales. El factor determinante ha sido la entrada de biosimilares al mercado, que, ofreciendo los mismos resultados clínicos, son significativamente más baratos debido a la competencia. Es decir, ahora el NICE los considera coste-efectivos para el sistema público sanitario. El tratamiento va a estar disponible como opción de primera y segunda línea cuando los tratamientos dirigidos o la inmunoterapia no son adecuados, lo que ofrece una nueva alternativa a los pacientes que, de otro modo, solo recibirían quimioterapia. En Inglaterra cada año se diagnostican 35.000 nuevos casos y se estima que casi 10.000 son en estadio metastásico. De ellos, podrán beneficiarse con esta nueva medida unos 7.000 pacientes al año. De igual forma, ha recomendado el uso de natalizumab como opción de tratamiento para la esclerosis múltiple remitente-recurrente altamente activa. También indican que es por la reducción del coste debida a la entrada de biosimilares al mercado. Esta medida permite que natalizumab sea una alternativa accesible que ayuda a frenar la progresión de la discapacidad y reducir los brotes en personas con enfermedad muy activa.
Instituto Nacional de Salud y Excelencia Clínica del Reino Unido
5
Informe
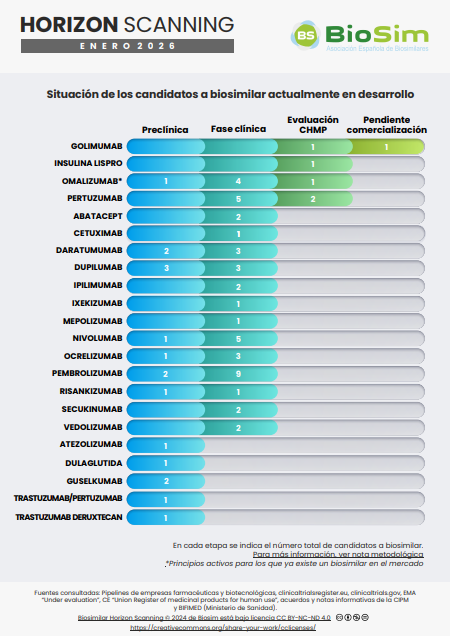
Horizon Scanning: enero 2026